COVID-19 salgını binlerce can alıyor ve dünya çapında görülme sıklığı yüz binlerce olarak ölçülüyor. Bu büyüyen tehdide karşı koymak için antiviraller ve aşılar acilen aranmaktadır. Şimdi, Temmuz 2020'de bioRxiv * ön baskı sunucusunda yayınlanan SARS-CoV-2 başak proteininin yapısal dinamikleri üzerine yeni bir çalışma, aşıların geliştirilmesi için bağışıklık hedefleri olabilecek epitoplar hakkında rapor vermektedir.
SARS-CoV-2 ve Glikosilasyon
Virüs, yüzeyinde, insan anjiyotensin dönüştürücü enzim (ACE) 2 reseptörüne bağlanmasından sorumlu olan trimerik bir başak proteini olan zarflı bir virüstür. Bu, viral membranın konakçı hücre zarıyla kaynaştığı ve virüsün konakçı hücreye girdiği, bir postfüzyon durumuna geçiş yapar.
Spike proteininin bol glikan kalıntıları, antikorların onu hedeflemesini önler ve ilaçların erişimini de engeller. Bu nedenle, bu çalışma Spike (S) proteininin yapısal değişikliklerini ve glikan kaplamadaki dinamik değişikliği yakalamayı amaçlamıştır. Araştırmacılar, glikosile S proteininin canlı bir resmini boyamak ve özellikle virüsün konakçı hücreye füzyonundan sorumlu olan S2 alt biriminde aday immünojenik epitopları tanımlamak için moleküler dinamikler (MD) simülasyonları kullandılar.
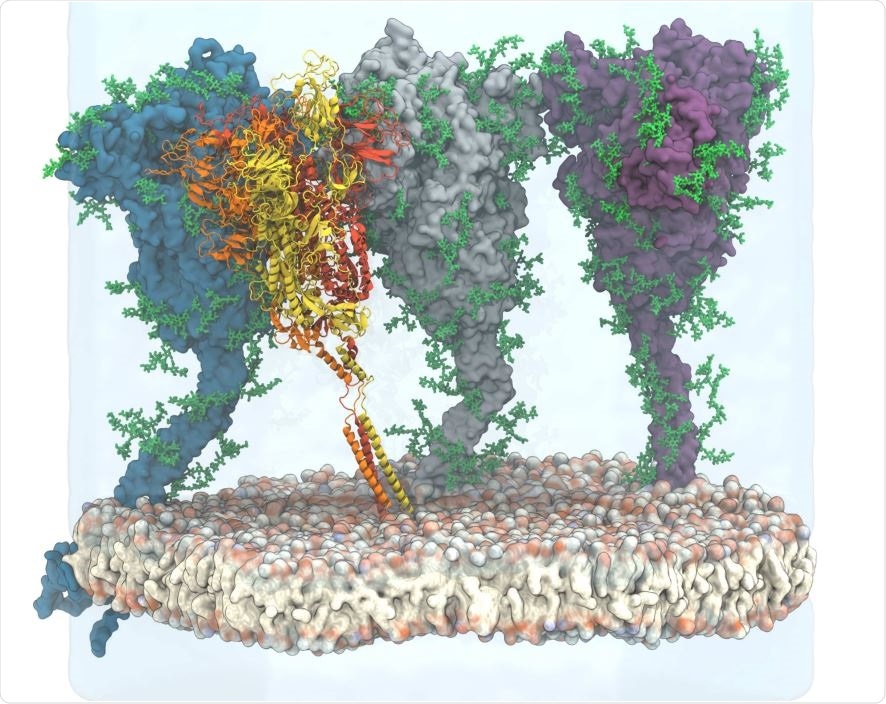
Spike Protein Erişilebilirliği
Antikorların, kendilerine bağlanmak için epitoplara erişimi olmalıdır. Mevcut analiz, yoğun glikan kalkanının S proteininin antikorlara erişimini önemli ölçüde azalttığını gösterdi. Herhangi bir zamanda, sivri yüzeyinin sadece küçük bir kısmı aslında bu şeker kalıntıları ile kaplıdır, ancak o kadar dinamiktirler ki tüm yüzeyi etkili bir şekilde korurlar. Bu hem ışın analizi hem de Fab yerleştirme çalışmaları ile görülmüştür.
En önemli koruyucu etkiler, glisinlenmemiş HR2 bobininin antikor saldırısına neredeyse tamamen açık olduğu membrana en yakın kısımda görülür. Yine de, glikosilasyon ile Fab fragmanı ve diğer büyük moleküller tarafından erişilemez hale gelir.
Spike Protein Sertliği
S proteininin, antikora kuvvetli ve spesifik olarak bağlanan hem sert hem de yapılandırılmış bölgelere ve dinamik bölgelere sahip olduğu bulunmuştur. Reseptör bağlanma alanı (RBD) ve yakın bölgeler benzer şekilde esnektir, bu da hem açık hem de kapalı durumlarda peptit zinciri yapısında belirgin farklılıklar gösteren araştırmaları destekler.
Öte yandan, füzyon peptidini kapsayan S2 alanı, molekülün bu kısmını ön-yapılandırma konfigürasyonunda sabit tutmak için gerekli olabilecek katı protein yapılarına sahiptir.
![MD simülasyonları ve biyoinformatik analizlerinden tanımlanan epitoplar. (A) ışın analizi ve (B) Fab rijit gövde kenetlenmesinden erişilebilirlik skorları, tümü 4 × 1.93 µs S proteini MD simülasyonlarının ortalaması olan (C) sertlik skorlarıyla birleştirilir. Ayrıca (D) bir sekans koruma skoru [31] ve (E) BepiPred-2.0 epitop sekans imza tahmini dahildir. (F) Birleşik epitop puanı. (G) Bilinen nötrleştirici antikorların bağlanma yerleri. A-F'deki yüksek renk yoğunluğu, daha yüksek bir skoru ve G'deki yüksek renk yoğunluğu, birden fazla farklı antikora bağlanan bölgeleri gösterir. Epitopes identified from MD simulations and bioinformatics analyses. Accessibility scores from (A) ray analysis and (B) Fab rigid body docking are combined with (C) rigidity scores, all averaged over 4 × 1.93 µs of S protein MD simulations. Also included are (D) a sequence conservation score [31], and (E) BepiPred-2.0 epitope sequence-signature prediction. (F) Combined epitope score. (G) Binding sites of known neutralizing antibodies. Higher color intensity in A-F indicates a higher score and higher color intensity in G indicates sites binding to multiple different antibodies.](https://www.news-medical.net/image.axd?picture=2020%2F7%2FssCapture.jpg)
Spike Protein Korunması
Araştırmacılar, kaçış mutasyonlarının ortaya çıkmasını önlemek ve yeni suşların çoğalmasına ve baskın hale gelmesine izin vermek için nispeten stabil epitoplara karşı antikorlar üreten aşılar geliştirmenin önemini vurgulamaktadır. Mevcut analiz, S proteininin yüksek oranda korunduğunu ve mevcut büyük veritabanlarında bu proteindeki amino asitlerin yarısından fazlası için hiçbir varyasyon bulunmadığını buldu.
İmmünojenikliği Tahmin Etme
Araştırmacılar, “Korunmuş, katı ve erişilebilir bölgeler genel olarak protein ortaklarının bağlanması için iyi adaylar sunuyor” dedi. Bu özellikleri kullanarak 4'ü bilinen 9 aday epitop ve kalan yeni epitopları buldular. Hepsi, esnek ve erişilemeyen sap bölgesinin aksine, molekülün yapılandırılmış bir kısmı olan başak proteininin baş bölgesinde idi.
Önceki Araştırmalarla Anlaşma
Önceki bir araştırmacı ekibi, nötrleştirici CR3022 antikorunun, S proteinin ekto alanına, ACE2 bağlanma bölgesinin ötesindeki bir epitopta bağlandığını keşfetti. Bu bağlanmayı sağlamak için, üç S protomerinden en az ikisi açık konfigürasyonda olmalıdır. Bu epitop, mevcut analizde ve CB6, H104 ve S309 gibi diğer antikorlara bağlanan epitoplarda geri kazanılır.
Diğer epitoplardan ikisi de, araştırmacıların sözleriyle, “epitop tanımlama metodolojimizin sağlam olduğunu” gösteren, antikorları nötralize ettiği bildirilen RBD bağlanma alanlarıyla eşleşir.
Glikosilasyon Siteleri Açığa Çıktı
Çalışma ayrıca, farklı glikosilasyon modellerinin proteinin erişilebilirliği üzerindeki etkisi üzerine daha önce yapılan araştırmaları doğruladı ve sürdürdü. Tek başına mannozun dahil olup olmadığını veya tam glikan kalkanının dikkate alındığını, Fab'ın sırasıyla% 60 ve% 80 etkili bir şekilde bloke edildiğini bulmuşlardır.
Araştırmacılar, “hafif bir glikan kapsama alanının bile proteinin antikor erişilebilirliğini önemli ölçüde azalttığını” söylüyorlar.
İmmünojenik Epitopların Özellikleri
İlk üç epitopun, beta-katlanmış ipliklerin yanı sıra esnek ilmeklere sahip olduklarını buldular. Bir sonraki, beş iplikçikli bir beta tabakasında yatan, çok kararlı bir düzenleme olan, diğeriyle çevrili bir alfa sarmalındaydı.
Sonraki ikisi, RBD'nin S proteini üzerindeki apikal kısmında, çoğunlukla açık ve kapalı durumlarda konformasyonel değişiklikler gösteren esnek döngülerdir. Diğerleri uzun ve kısa esnek halkalardan veya sabit bir sarmaldan oluşur.
Gelecek Aşı Tasarımı
Araştırmacılar, sağlam bir immünojenik profil sağlamak için tanımlanan epitopları sunmaya çalıştılar. Bu proteinler bağımsız olarak katlanırsa, S proteini farklı alanlardan oluştuğu için epitopları koruyabileceklerini ve böylece antikorların bir aşı tarafından ortaya çıkmasına izin verebileceklerini söylüyorlar. Bu, belki de sekansları uygun şekilde modifiye ederek sunulabilir.
Çalışma şu sonuca varıyor: “Bu makalede ortaya koyduğumuz yaklaşım, tüm beta ailesine karşı geniş korumayı garanti eden evrensel bir aşı üretmek amacıyla çeşitli betacoronavirüslerin entegre analizinden elde edilen epitopları tahmin etmek için genişletilebilir.”
* Önemli Uyarı
bioRxiv hakemli olarak gözden geçirilmeyen ve bu nedenle kesin, klinik uygulama / sağlıkla ilgili davranışlara yol göstermeyen veya yerleşik bilgi olarak değerlendirilmemesi gereken ön bilimsel raporlar yayınlar.

You must be logged in to post a comment Login
Leave a Reply
Yorum yapabilmek için oturum açmalısınız.